*成人のうつ病患者(既存の抗うつ剤治療で十分な効果が認められない場合に限る)の治療
rTMS*1は、パルス磁場によって渦電流を誘導し皮質ニューロンを刺激することで、非侵襲的に皮質や皮質下の活動を変化させる治療法です。
*1 rTMS(repetitive transcranial magnetic stimulation):反復経頭蓋磁気刺激
【監修】 鬼頭 伸輔 先生(東京慈恵会医科大学 精神医学講座 主任 教授)
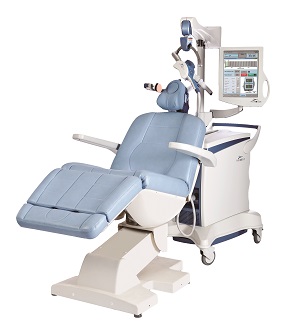
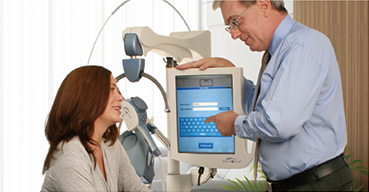
NeuroStar TMS 治療装置はパルス磁場を用いて脳皮質の局所領域に電流を誘導し、ニューロンを刺激することによって、成人のうつ病患者(既存の抗うつ剤治療で十分な効果が認められない場合に限る)の治療に用います。
NeuroStar TMS 治療装置はパルス磁場を生成し、局所的な渦電流を誘導します。皮質内に生じた渦電流がニューロンを刺激し、神経伝達物質が放出されます。規則的な刺激を繰り返し行うことで、生理学的変化をもたらし、うつ症状の改善が期待できます。
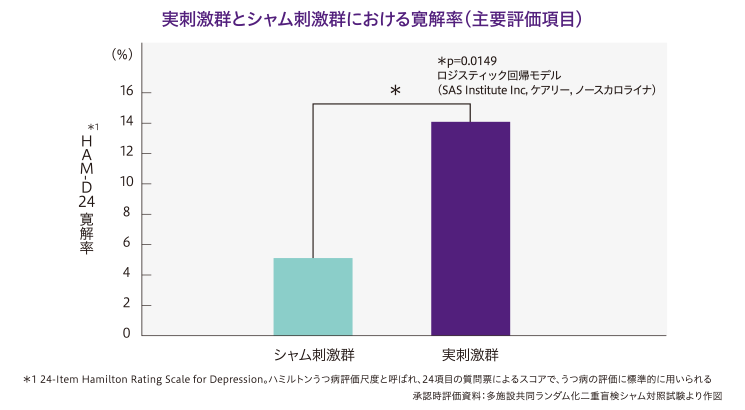
6週までの寛解率は、実刺激群14.1%(13/92例)、シャム刺激群5.1%(5/98例)で、シャム刺激群に対する実刺激群の優越性が示されました。
大うつ病性障害患者を対象に高頻度rTMSの有効性および安全性を検討する。
抗うつ剤による薬物治療で十分な効果が認められず、DSM-Ⅳで大うつ病性障害と診断された成人患者*2190例(実刺激群92例、シャム刺激群98例)。
2週間の無治療の導入期、3週間固定の治療期および最長3週間の追加治療期(臨床的改善*3を示した被験者対象)を実施した。
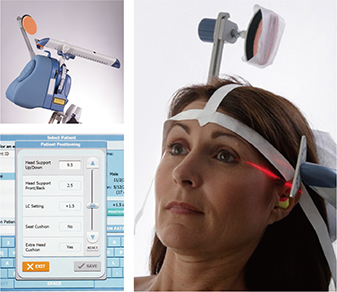
左背外側前頭前野への高頻度rTMS(刺激頻度10Hz、刺激強度120%MT*4、刺激時間4秒間、非刺激時間26秒間、1セッションつき3000パルス)を週5セッション実施した。
磁界を遮断する金属製インサートを備えた類似コイルと、実刺激と同じ体性感覚刺激を送出する頭皮電極を使用した。
全ての被験者は、ベースライン評価前の2週間(フルオキセチンについては5週間)および治療期間中は抗うつ剤、抗精神病薬および抗けいれん薬は使用しなかった。鎮静薬および睡眠薬の限定的使用または抗不安薬の限定的使用は認められた。
主要評価項目 : HAM-D24合計点での寛解率(寛解はHAM-D24合計点が評価時点2連続で9点以下または最終評価時に3点以下)。
副次評価項目 : HAM-D24合計点での反応有無(反応は、合計点がベースラインより50%以上低下)等。
主要評価解析対象集団はintention-to-treat(ITT)集団とした。主要評価項目および副次評価項目はロジスティック回帰モデルを使用して評価した〔独立変数は処置(実刺激・シャム刺激)、薬剤抵抗性の程度(低い・高い)、現在のエピソード期間、年齢、施設〕。
有害事象の発現率は、頭痛が実刺激群30.4%(28/92例)、シャム刺激群23.5%(23/98例)、刺激部位不快感が実刺激群18.5%(17/92例)、シャム刺激群10.2%(10/98例)、不眠症が実刺激群7.6%(7/92例)、シャム刺激群10.2%(10/98例)、うつ病または不安の悪化が実刺激群6.5%(6/92例)、シャム刺激群8.2%(8/98例)、胃腸障害が実刺激群6.5%(6/92例)、シャム刺激群3.1%(3/98例)、疲労感が実刺激群5.4%(5/92例)、シャム刺激群4.1%(4/98例)、筋肉痛が実刺激群4.3%(4/92例)、シャム刺激群4.1%(4/98例)、回転性眩暈が実刺激群2.2%(2/92例)、シャム刺激群2.0%(2/98例)、皮膚疼痛が実刺激群1.1%(1/92例)、シャム刺激群1.0%(1/98例)、顔面筋攣縮が実刺激群0%(0/92例)、シャム刺激群1.0%(1/98例)等であった。
実刺激群の重篤な有害事象として試験を中止した失神1例を認めたが、治験担当医は本品との因果関係は否定的と判定した。

| 一般的名称 | 経頭蓋治療用磁気刺激装置 |
|---|---|
| 販売名 | NeuroStar TMS 治療装置(冷却機構なしモデル) |
| 承認番号 | 22900BZI00029000 |
| 医療機器分類 | 高度管理医療機器(特定保守管理医療機器) |
| 電気的定格 |
■本体
|
| 寸法 | 幅84cm×長さ234cm×高さ188㎝ |
| 重量 | 198kg |
| 製造業者 | ニューロネティクス社(Neuronetics,Inc) |
| 選任製造販売業者 | ヴォーパル・テクノロジーズ株式会社 |
| 販売業者 | 帝人ファーマ株式会社 |
| 警告 |
<適用対象(患者)>
|
※製品は、性能向上のため予告なしに寸法や仕様を変更することがあります。
<ご使用にあたっての注意>
・警告、禁忌・禁止、使用目的又は効果、使用上の注意等については、電子添文および取扱説明書をご参照ください。